26일 보건복지부와 식품의약품안전처는 혁신적 의료기기가 식약처의 국제적 수준의 임상평가를 거친 경우 별도의 신의료기술평가 없이 시장(의료현장)에 즉시 진입해 사용할 수 있도록 하는 ‘시장 즉시진입 의료기술’ 제도를 이날부터 도입·시행한다고 밝혔다.
신의료기술평가는 새로운 의료기술이 시장에 진입하기 위해 거쳐야 하는 절차다. 새로운 의료기술은 안정성·유효성을 검증받아야 의료현장 사용이 가능하다.
이에 정부는 혁신적 의료기기를 시장에 즉시 진입하게 하는 제도를 마련하고 ‘신의료기술평가에 관한 규칙’ 및 ‘의료기기 허가·신고·심사 등에 관한 고시’를 동시에 개정했다. 개정에 따라 식약처 허가 단계에서 국제적 수준의 임상 평가를 거친 새로운 의료기기를 활용한 새로운 의료기술은 시장에 즉시 진입할 수 있게 된다.
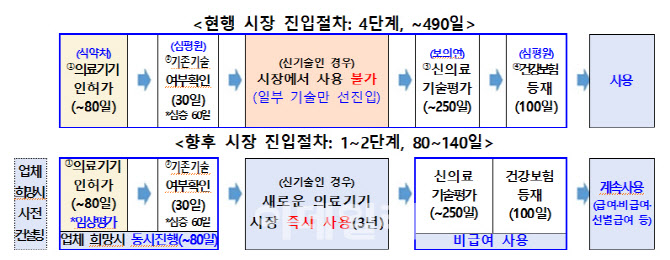
시장 즉시진입 의료기술의 대상이 되는 의료기기는 인공지능(AI) 적용 디지털의료기기, 체외진단 의료기기, 의료용 로봇 등이다. 이와 함께 의료기기 업체 희망 시 식약처 인허가 단계에서 기존 기술 여부 확인을 동시에 진행할 수 있게 하는 등 절차도 간소화한다. 이로써 인허가부터 현장에서 사용되기까지 최장 490일 소요되던 시장 진입 기간을 최단 80일로 단축할 수 있게 된다.
정부는 신속한 시장 진입과 함께 사후 관리도 강화하기로 했다. 비급여 남용 방지와 환자 부담 경감을 위해 필요 시 복지부 장관 직권으로 신의료기술평가를 실시해 건강보험 급여 여부를 결정할 수 있도록 했다. 안전성이 확인되지 않은 의료기술은 시장에서 퇴출할 방침이다.
곽순헌 복지부 보건의료정책관은 “안전하지 않은 의료기술은 시장에서 퇴출하고 환자부담 완화를 위해 비급여 사용현황을 모니터링해 새로운 제도가 의료현장에 정착될 수 있도록 관계기관과 지속 협력하겠다”라고 강조했다.
이남희 식약처 의료기기안전국장은 “시장진입 개선방안 추진과 함께 환자 안전을 간과할 수 없는 만큼 허가·인증 시 강화된 임상평가자료를 통해 의료기기의 안전성 확보도 놓치지 않을 계획”이라고 말했다.
개정 관련 자세한 내용은 국가법령정보센터 또는 복지부 누리집→정보→법령, 식품의약품안전처 누리집→법령/자료→법령정보→고시훈령예규 에서 확인할 수 있다.