
강주경(왼쪽부터), 설태준 공동1저자, 임대식 교수(사진=KAIST)
연구팀은 세포 성장과 분화를 조절하는 히포(Hippo) 신호전달경로의 핵심 인자인 얍/타즈(YAP/TAZ)가 지방세포 생성 과정에서 후성유전체 수준의 제어 스위치로 작용한다는 사실을 규명했다. 얍/타즈가 하위 표적 유전자인 비글스리(VGLL3)를 통해 지방세포 형성에 관여하는 유전자들의 작동을 광범위하게 억제한다는 메커니즘이다.
지방세포는 한 번 형성되면 수를 줄이기 어렵기 때문에 비만, 지방간, 인슐린 저항성 등 대사질환 치료의 주요 난제로 꼽혀왔다. 그동안 지방세포 분화 조절은 개별 유전자 수준의 연구에 머물렀으나 이번 연구는 유전자 발현을 조절하는 DNA 조절 환경인 ‘후성유전체’ 차원에서 지방세포 형성을 제어할 수 있음을 제시했다는 점에서 의미가 크다.
연구팀은 지방 전구세포가 성숙한 지방세포로 분화하는 전 과정을 추적하며, 차세대 염기서열 분석 기술을 활용해 유전자 발현과 후성유전체 변화를 동시에 분석했다. 그 결과 얍/타즈가 활성화되면 지방세포의 정체성을 결정하는 유전자 프로그램이 작동하지 못하고, 에너지 저장을 조절하는 핵심 인자인 ‘PPARγ’중심의 지방세포 분화 네트워크 전반이 억제되는 것으로 나타났다.
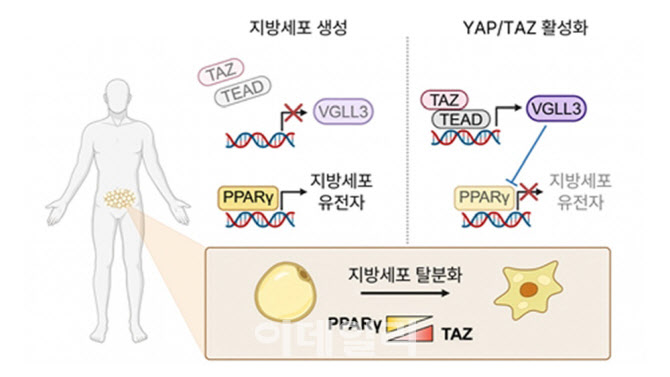
지방세포 유전자 조절 모식도(사진=KAIST)
연구팀은 이번에 규명한 ‘YAP/TAZ·VGLL3·PPARγ’ 조절 축이 지방세포 형성과 기능 이상을 정밀하게 제어하는 핵심 기전이 될 수 있다고 설명했다. 이를 통해 비만과 대사질환을 보다 근본적으로 조절하거나 맞춤형 치료 전략으로 확장할 수 있을 것으로 기대하고 있다.
임대식 교수는 “지방세포 분화가 단순한 유전자 조절을 넘어 후성유전체 수준에서 정교하게 제어된다는 점을 처음으로 규명한 연구”라며 “대사질환의 새로운 치료 전략을 설계하는 데 중요한 기초 자료가 될 것”이라고 말했다.
이번 연구는 KAIST 생명과학과 설태준 박사과정생과 강주경 박사가 공동 제1저자로 참여했으며, 과학기술정보통신부와 한국연구재단의 리더연구자 지원사업과 해외우수과학자 유치사업의 지원을 받아 수행됐다.










